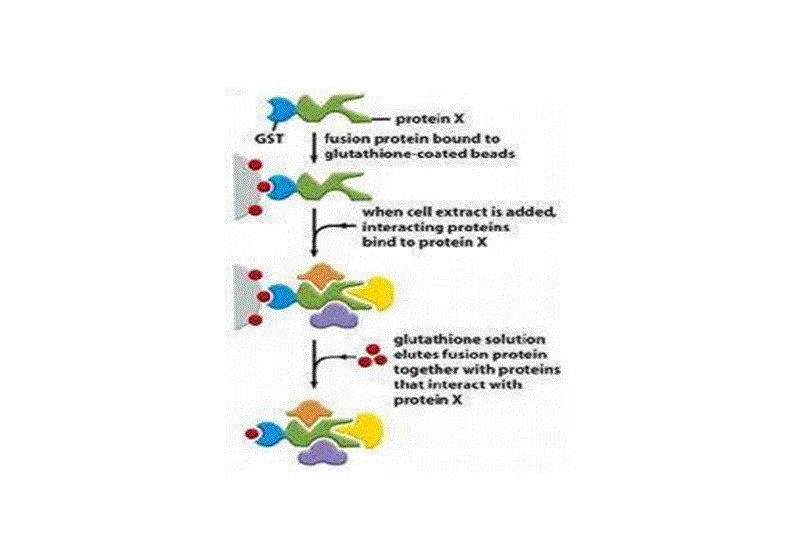
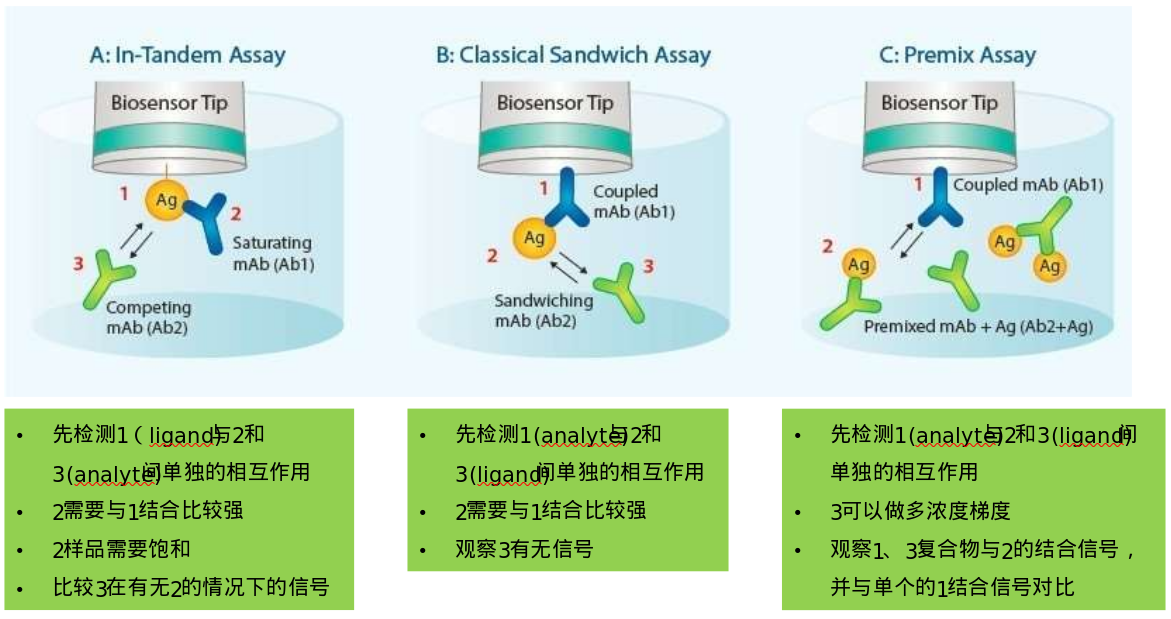
分子互作
提起分子互作,不可避免的要提起中心法则中的三大主体:DNA,RNA和蛋白质。 分子互作就是指三大主体之间的相互作用。亲和力是判定分子间相互作用的重要参数, 是了解分子以及识别生物学过程、药物的发现与筛选的重要指标。对于药效的评价、 生物大分子及其复合体的稳定性的评估需要从动力学、热力学和稳定性等方面进行 包括分子间的结合、结合的快慢、结合的强弱、结合的机理等多方面的全面性的研究.
SPR生物分子相互作用分析仪—BIACORE8K/3000
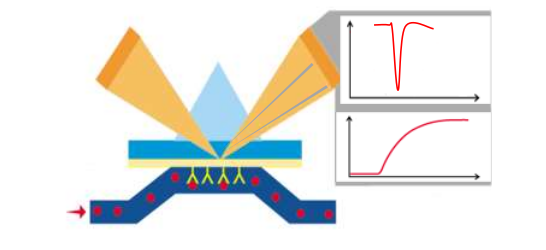
生物分子相互作用分析仪(BIACORE)利用表面等离子共振SPR原理,能够实时、动态、有序、高精度地检测不同
类型生物分子之间的相互作用;
可检测生物分子间的相互作用动力学和亲和力,分子识别与结合选择性以及功能复合物的组装等,目标分子活性含
量的检测
适用于蛋白质与蛋白质﹑蛋白质与核酸﹑蛋白质与多糖﹑蛋白质与小分子化合物﹑抗原与抗体﹑药物靶点与小分子
抑制剂等生物分子之间的相互作用的动力学和亲和力分析,以及小分子化合物、生物药物的筛选等;

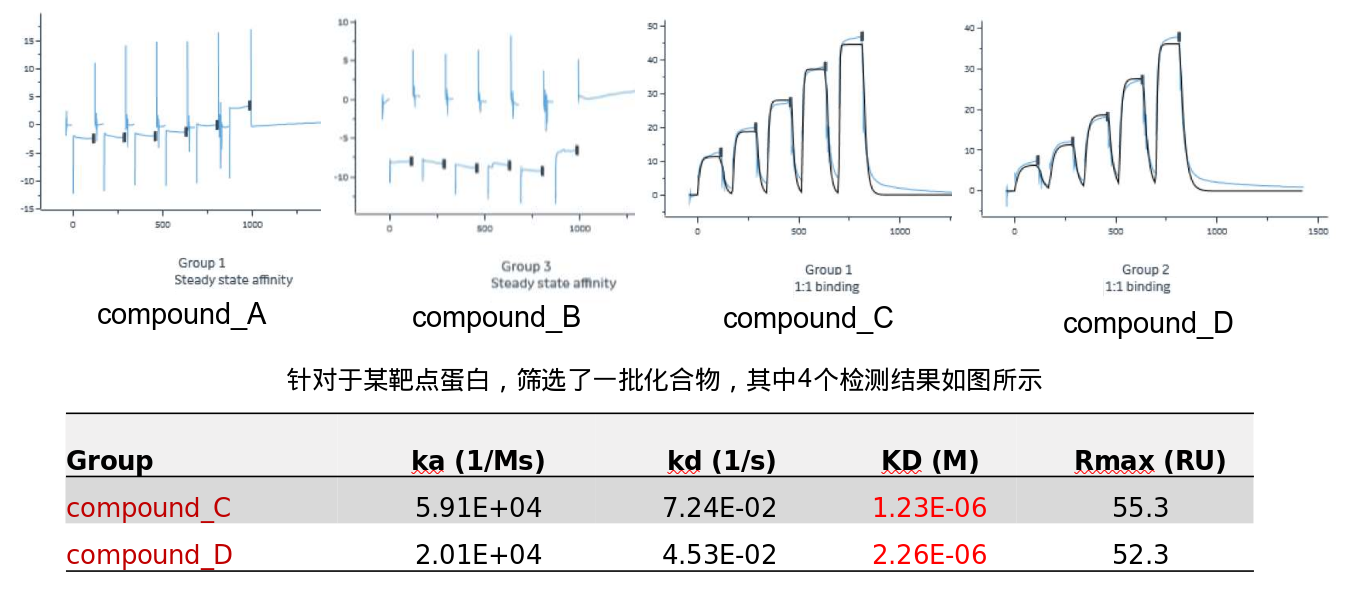
支撑案例—小分子化合物药物的筛选
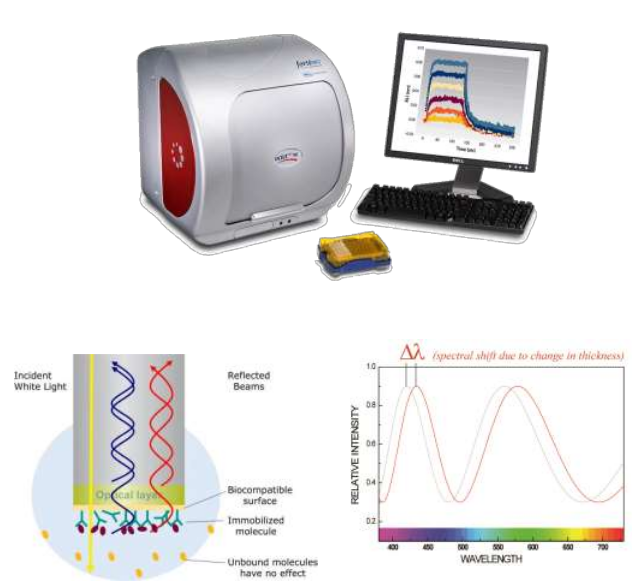
BLI生物分子相互作用分析仪—OCTET RED96
生物分子相互作用分析仪(OCTET RED96)利用生物层干涉BLI原理,实时监测生物分子间的相互作用;
适用于蛋白质与蛋白质﹑蛋白质与核酸﹑蛋白质与多糖﹑蛋白质与小分子化合物等生物分子之间的相互作用的
动力学和亲和力分析;
可用于检测多分子相互作用,例如抗原表位竞争或复合物多分子组装等;
用于混合体系中分子的浓度测定,例如细胞上清或细胞裂解物中某分子浓度的定量,检测范围广,操作简单.
抗原表位竞争
等温滴定微量热仪(AFFINITY ITC LV)
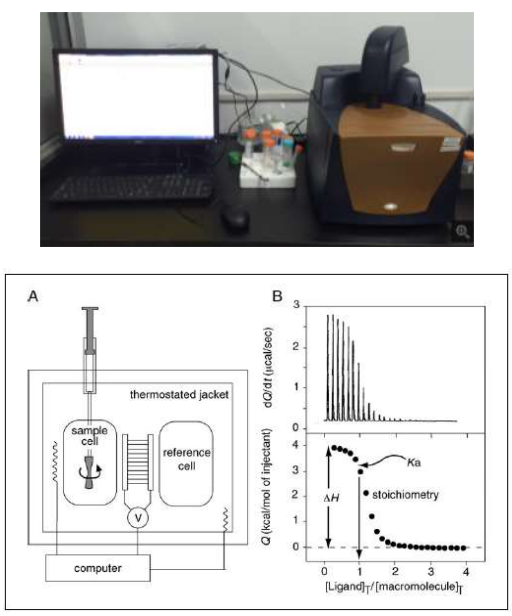
等温滴定量热法(Isothermal Titration Calorimetry)通过高灵敏度、高自动化的微量量热仪连续、准确地监测和记录一个变化过程的量热曲线,提供亲和力和热力学信息,包括:结合常数KA/KD,结合焓(ΔH),结合化学计量比(n),熵变( Δ S)和自由能( Δ G)。
与结构生物学结合,可以为化学药物的开发提供重要数据

等温滴定微量热仪(AFFINITY ITC LV)
nanoDSF
源于德国 NanoTemper 公司

nanoDSF 是一种高级的差示扫描荧光技术 (Differential Scanning Fluorimetry) 。
此技术可检测所有蛋白色氨酸和酪氨酸荧光的最微小变化。
蛋白中色氨酸和酪氨酸的荧光与其所处的环境密切相关。因此,通过检测荧光变
化,可真正实现在非标记环境下测定蛋白的化学稳定性和热稳定性。
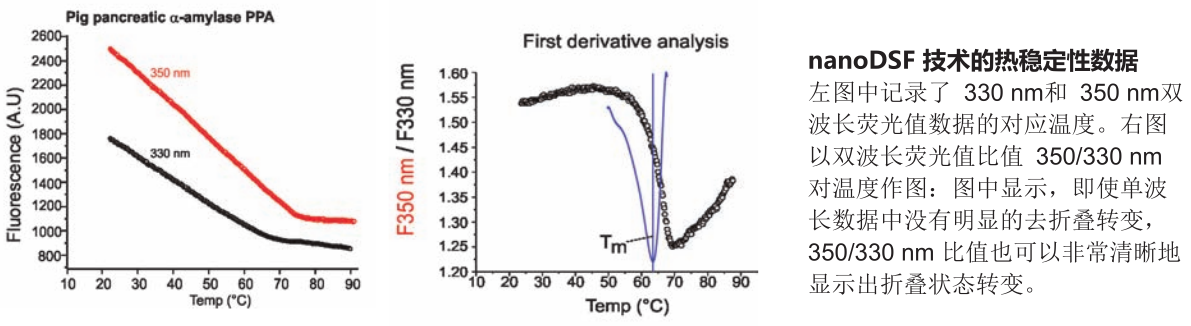
由 NanoTemper 公司研发的通过实时荧光检测,可提供无以伦比的扫描速度和 高密度的数据点。超高分辨率的去折叠曲线甚至可以检测到瞬间的去折叠现象。
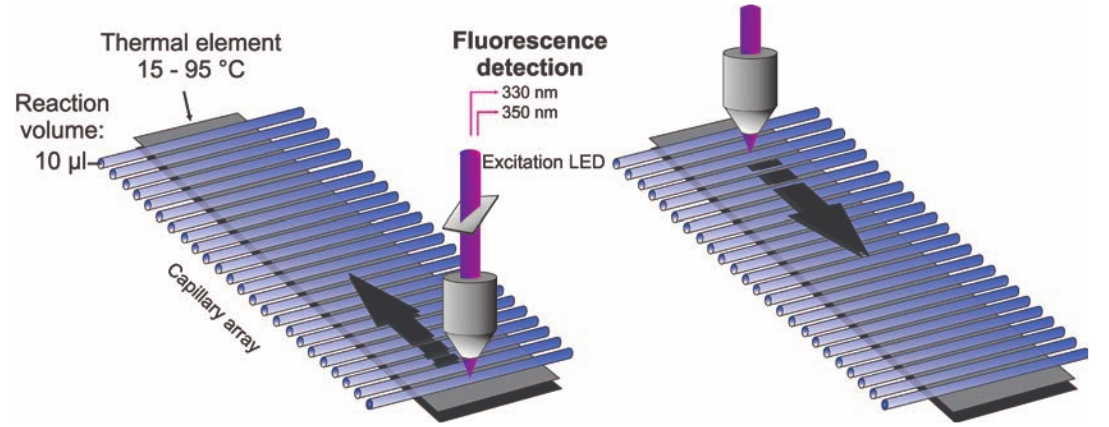
此外,由于不像传统 DSF 技术需要外源荧光基团作为信号源,nanoDSF 的检测 过程不受任何缓冲液限制,并且适用于非常广泛的浓度范围 (250 mg/ml - 5 μg/ml) , 因此,此技术可用于去垢剂溶解的膜蛋白和高浓度抗体制剂的稳定性分析。
技术对比 : nanoDSF and µDSC
知名 CRO 企业的合作研究证实 nanoDSF 技术能够克服 μDSC 技术的多个主要缺 点: nanoDSF 更易于使用,测试速度是 μDSC 的 100 倍,样品消耗量却仅有其1/40。
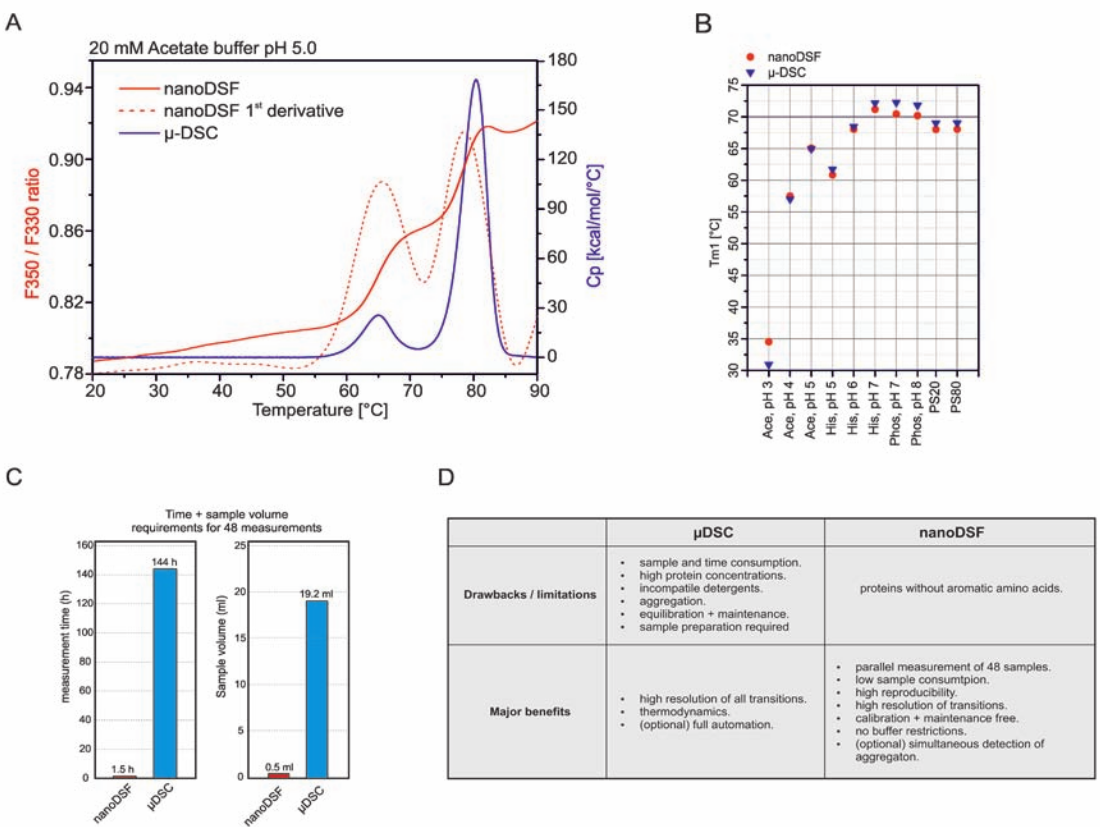
在商业化单克隆抗体小规模制剂筛选中, nanoDSF 和 μDSC 都能够获得精确并高
度一致的 Tm 值(A 和 B)。此筛选共测定了10 种不同缓冲液或 pH 值的制剂条件,
以及是否添加聚山梨醇脂 20 和 80 。聚山梨醇脂 20 和 80 是单抗制剂中常用的去垢
剂,此类样品无法使用传统的 DSF 方法进行测试。
PR NT.48 集成化的 nanoDSF 分析方法和创新性的毛细管上样方式,能够很好地
克服 μDSC 的主要功能缺陷(C 和 D)。除了测定速度快、数据精确性高和通量高以
外,nanoDSF 不需要繁琐的仪器维护和耗时耗力的样品制备(例如透析和过滤)。因
此,PR NT.48 是生物药物研发中进行快速、精准热稳定性筛选的理想仪器。
抗体的热稳定和胶体稳定性分析
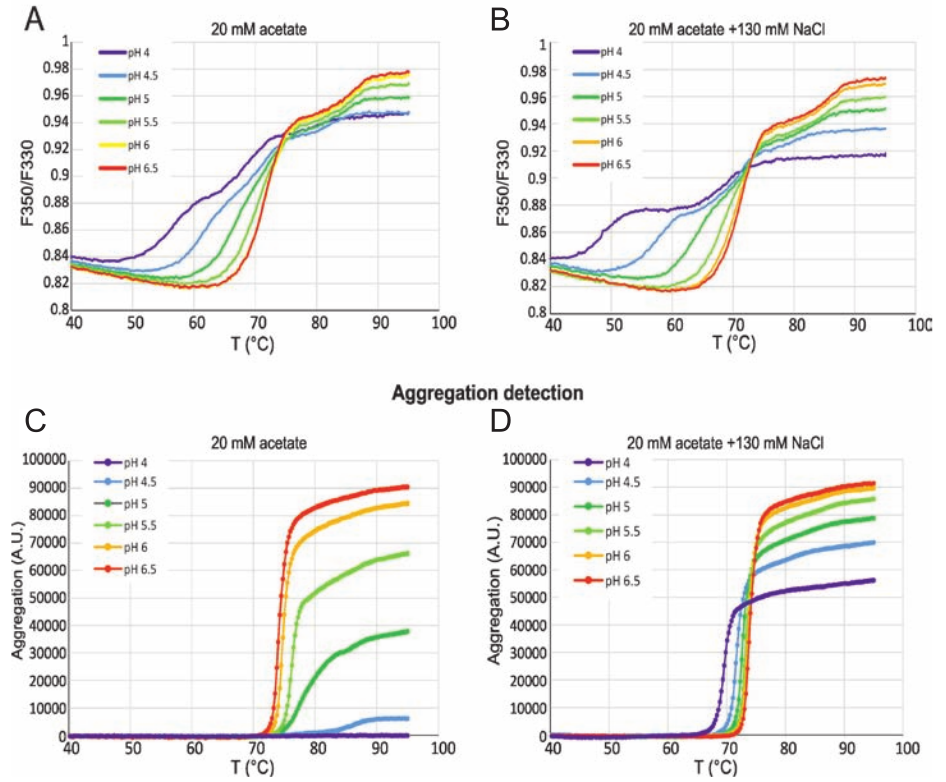
单克隆抗体在不同缓冲液中的构象稳定性与聚集
(A 和 B)在不同 pH 值和 NaCl 浓度条件下,通过检测荧光比值 (F350/F330) 的变化测定单抗的热稳定性。
(C 和 D)通过检测背向反射光变化测定聚集。
PR NT.48 能够为抗体缓冲液筛选项目提供高质量的热稳定性数据,并能够检测
单个抗体结构域的去折叠信号(A 和 B)。PR NT.48 宽泛的检测范围允许用户测定
250 mg/ml - 5 μg/ml 浓度范围内抗体的热稳定性。此外,应用背向反射光学模块能
够同时获得抗体的胶体稳定性数据和聚集起始温度(C 和 D)。
使用 PR NT.48 平行测定热稳定性和聚集的结果显示:对抗体而言,在可以减少
聚集的条件下,轻微的热不稳定是可以接受的,甚至对长期稳定性是有利的(D)。
因此,未来可以设计筛选方法去寻找既能在低 pH 值条件下增加抗体热稳定性,同时
又能将去折叠状态维持在低聚集的添加剂环境中。
质量控制
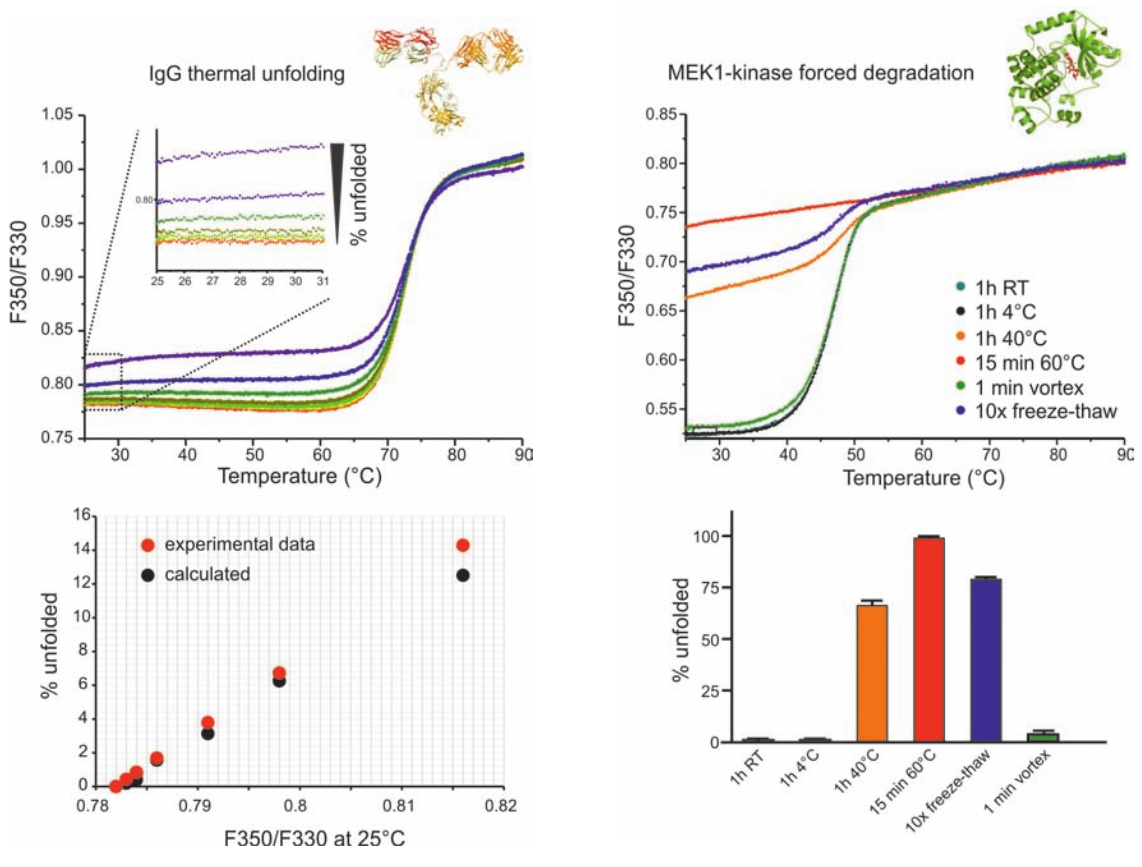

nanoDSF 可快速检测并定量去折叠蛋白,进而用于质量控制。该方法具有非比寻
常的速度,同时其操作过程还非常简单。
直接将储存液装载到毛细管中就可进行上图所示的质量控制实验,无需费时费力的
样品制备过程。然后仅需要点击一次按钮,软件便会记录多至 48 个样品的 F350/F330
值,并在数秒内显示稳定性数据。

